В вакуумных электронных приборах, таких как катодно-лучевая трубка, анод — это положительно заряженный коллектор электронов. В трубке анод — это положительно заряженная пластина, которая захватывает электроны, вылетающие из катода, за счет электрического притяжения. Это ускоряет параллельный поток этих электронов.
Что такое анод и катод
Термины, встречающиеся в электричестве, включают анод и катод. Это относится к источникам энергии, гальванике, химии и физике. Этот термин также встречается в вакуумной электронике и полупроводниках. Он относится к клеммам или контактам устройств и к тому, какой электрический знак они имеют. В этой статье объясняется, что такое анод и катод и как определить, где они находятся в электролите, диоде и батарее, какие из них положительные, а какие отрицательные.
В электрохимии существует два основных модуля:
- Гальванические элементы – производство электричества за счет химической реакции. К таким элементам относятся батарейки и аккумуляторы. Их часто называют химическими источниками тока.
- Электролиз – воздействие на химическую реакцию электроэнергией, простыми словами – с помощью источника питания запускается какая-то реакция.
Рассмотрите окислительно-восстановительную реакцию в гальваническом элементе, и какие процессы происходят на его электродах?
- Что такое электроды в электроде?— это электрод, на которомреакция окисленият.е.это процесс окисления, в результате которого происходит реакция окисления (т.е. одна из реакций окисления). Электрод, на котором происходит реакция окисления, называетсявосстановителем.
- катод— электрод, на котором происходитреакция восстановленият.е.принимает электроны. Электрод, на котором происходит реакция восстановления, называетсяокислитель.
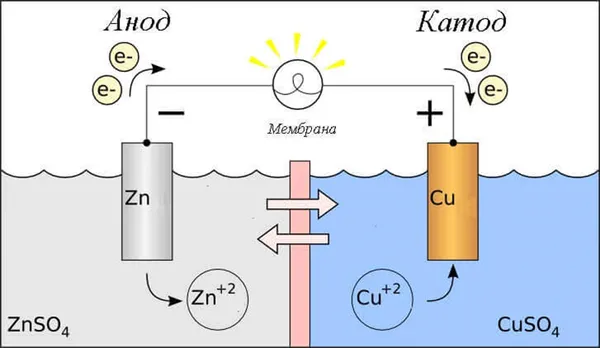
В связи с этим возникает вопрос: Где находится плюсовая сторона и где находится минусовая сторона батареи? По определению, в гальваническом элементеанод отдает электроны.
Важно! В ГОСТ 15596-82 есть официальное определение клемм химического источника тока, если коротко, то положительный полюс находится у катода, а отрицательный — у анода.
В данном случае рассматривается протекание электрического токаво внешнем проводнике цепиотокислителя (катод)квосстановитель(анод). Поскольку электроны в цепи текут от минуса к плюсу и электрический ток обратный, катод находится в плюсе, а анод в минусе.
Внимание: ток всегда течет к аноду!
Или то же самое на диаграмме:

Процесс электролиза или зарядки аккумулятора
Эти процессы аналогичны и обратны гальваническому элементу, так как здесь энергия поступает не за счет химической реакции, а наоборот — химическая реакция происходит за счет внешнего источника тока.
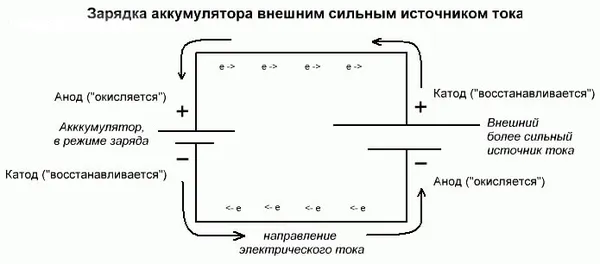
В этом случае положительная сторона источника энергии по-прежнему называется катодом, а отрицательная — анодом. С другой стороны, контакты заряжаемого гальванического элемента или электроды электролита уже имеют противоположные названия — давайте разберемся, почему!
Важно! При разрядке гальванического элемента анод отрицательный, катод положительный, при зарядке — наоборот.
Поскольку ток течет от положительного полюса источника питания к положительному полюсу батареи, батарея уже не может быть катодом. Из этого можно сделать вывод, что в данном случае электроды аккумулятора условно обмениваются в процессе зарядки.
Электрод заряжаемого гальванического элемента, по которому течет электрический ток, называется анодом. Во время зарядки положительная сторона батареи становится анодом, а отрицательная — катодом.
Гальванотехника
Процессы осаждения металлов путем химической реакции под воздействием электрического тока (электролиз) называются гальванической механикой. Таким образом, в мире получают ювелирные изделия и аксессуары, посеребренные, позолоченные, хромированные или покрытые другими металлами. Этот процесс используется как в декоративных, так и в прикладных целях — для повышения коррозионной стойкости различных механических узлов.
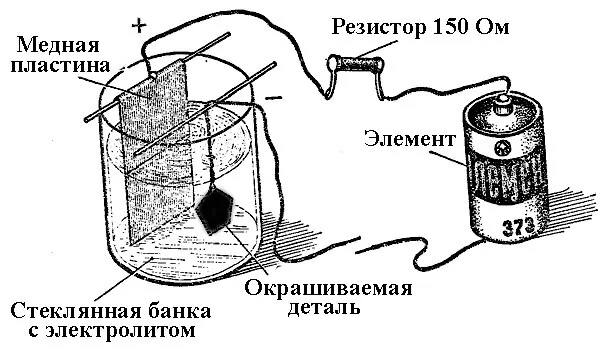
Основной принцип работы гальванических систем заключается в использовании в качестве электролита солевых растворов элементов, на которые наносится покрытие.
При электролитической гальванике анодом также является электрод, к которому подключен положительный полюс источника тока, или катод — в данном случае отрицательный полюс. Металл осаждается на минусовом электроде (реакция восстановления). Поэтому, если вы хотите сделать позолоченное кольцо своими руками, подключите минусовой провод источника тока и поместите его в емкость с соответствующим раствором.
Электролиз
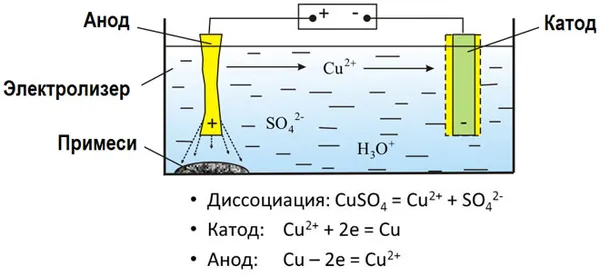
Электролиз (греч. electron — янтарь + solution — разложение) — это химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их компоненты под воздействием электрического тока.
При электролизе катионы (положительно заряженные ионы) движутся к катоду (отрицательно заряженному), а отрицательно заряженные ионы (анионы) — к аноду (положительно заряженному).
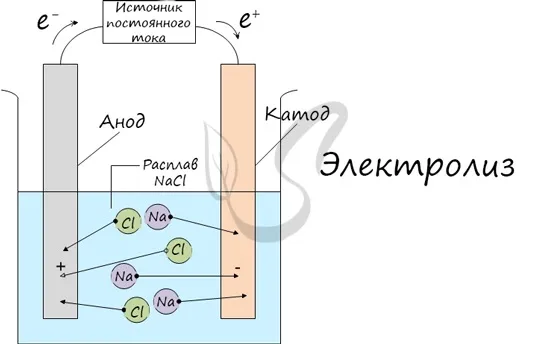
Таким образом, анионы и катионы движутся к аноду и катоду соответственно. Здесь и происходит химическая реакция. Для успешного решения задач по данной теме и написания реакций необходимо разделять процессы на катоде и аноде. Именно так будет строиться данная работа.
катод
Катионы — положительно заряженные ионы, такие как Na + , K + , Cu 2+ , Fe 3+ , Ag + и др. — притягиваются к катоду.
Чтобы определить, какая реакция происходит на катоде, сначала необходимо определить активность металла: его положение в электрохимическом порядке напряжений металла.
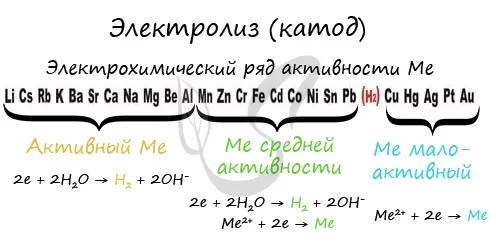
Если в катоде появляется активный металл (Li, Na, K), то вместо него воспламеняются молекулы воды, из которых выделяется водород. Если появляется умеренно активный металл (Cr, Fe, Cd), в катод выделяется и водород, и сам металл. Слабоактивные металлы выделяются только в катод (Cu, Ag).
Следует отметить, что алюминий считается границей между активными и умеренно активными металлами в диапазоне напряжений. При электролизе металлы до алюминия включительно (тоже!) на катоде не восстанавливаются, но восстанавливаются молекулы воды — выделяется водород.
Если ионы водорода — H + (например, при электролизе HCl, H2SO4), водород восстанавливается молекулами кислоты: 2H + — 2e = H2
Что такое электроды в электроде?
Отрицательно заряженные анионы притягиваются к аноду: SO42- , PO43- , Cl — , Br — , I — , I — , F — , S 2- , CH — , CH3COO — .

При электролизе кислородсодержащих анионов SO42- , PO43- — , окисляются не анионы на аноде, а молекулы воды, из которых высвобождается кислород.
Анионы без кислорода окисляются и выделяют соответствующие галогены. Ион серы окисляет серу. Исключением является фтор — когда он попадает на анод, молекула воды устраняется и выделяется кислород. Фтор — самый электромагнитный элемент и поэтому является исключением.
Анионы органических кислот окисляются особым образом: радикал рядом с карбоксигруппой удваивается, а сама карбоксигруппа (COO) превращается в углекислый газ — CO2.
Примеры растворов
Во время обучения вы можете столкнуться с металлами, которые отсутствуют в ряду активности. На этапе обучения вы можете использовать расширенную серию активности металлов.
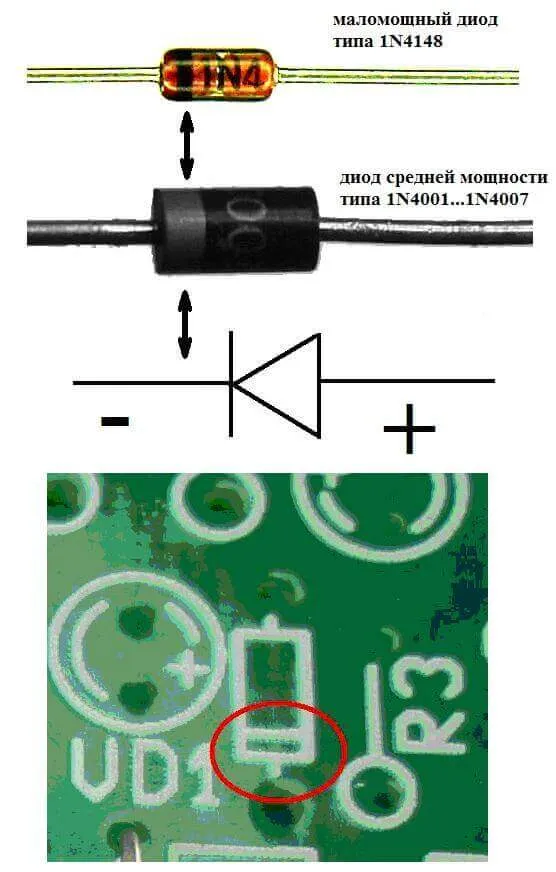
Теперь вы точно знаете, что выделяется в катоде 😉
Так что давайте потренируемся. Давайте выясним, что выделяется на катоде и аноде при электролизе AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Что такое анод и катод?
Часто возникает проблема определить, какой электрод является катодом, а какой — анодом. Для этого необходимо сначала разобраться в терминах.
В сложных веществах электроны неравномерно распределены между атомами соединений. В результате взаимодействия частицы переходят от атома одного вещества к атому другого вещества. Эта реакция называется реакцией окисления-восстановления. Потеря электронов называется окислением; элемент, который отдает электроны, называется восстановителем.
Подача электронов называется восстановлением; ведущим элементом в этом процессе является окислитель. Передача электронов от восстановителя к окислителю может происходить по внешней цепи и использоваться в качестве источника электричества. Устройства, которые могут преобразовывать энергию химической реакции в электричество, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины из разных металлов, погруженные в раствор электролита. В этой системе в одном металле происходит окисление, а в другом — восстановление.
Электрод, на котором происходит окисление, называется анодом. Электрод, на котором происходит восстановление, называется катодом.
Гальванический медно-цинковый элемент, поглощающий энергию реакции между цинком и сульфатом меди, является хорошо известным примером из учебников химии. В аппарате Якоби-Дэниела медная пластина погружается в раствор сульфата меди (медный электрод), а цинковая пластина погружается в раствор сульфата цинка (цинковый электрод). Цинковый электрод выделяет катионы в раствор, создавая избыток положительного заряда в растворе, а медный электрод удаляет катионы из раствора, делая раствор отрицательно заряженным.
Читайте также.
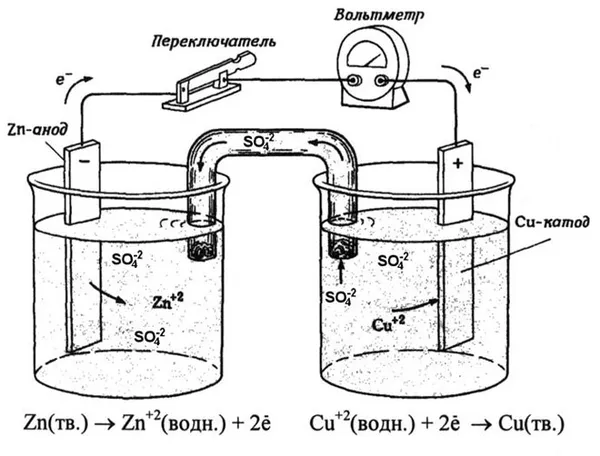
Как электроны представлены на диаграммах? Равновесные отношения на границах фаз нарушаются. Происходит окислительно-восстановительная реакция.
Энергия спонтанной химической реакции преобразуется в электрическую энергию.
Когда химическая реакция запускается внешней электрической энергией, происходит процесс, называемый электролизом. Процессы, происходящие при электролизе, обратны тем, которые происходят при работе гальванического элемента.
ПРЕДУПРЕЖДЕНИЕ Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, в то время как анод заряжен положительно.
Применение в электрохимии
Аноды и катоды участвуют во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваностегия;
- Гальванопластика.
Путем электролиза расплавленных соединений и водных растворов получают металлы, очищают металлы от примесей и извлекают ценные компоненты (электролитическое рафинирование). Пластины отливаются из металла, подлежащего рафинированию. Пластины помещают в электролит в качестве анодов. Металл растворяется под действием электрического тока. Катионы металла проходят через раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в исходном сыром металлическом листе, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролит, где они удаляются. Медь, никель, свинец, золото, серебро, золото и олово рафинируются электролитическим способом
При электролитической экстракции металлы извлекаются из раствора путем электролиза. Чтобы перевести металл в раствор, его обрабатывают специальными реагентами. В результате этого процесса получается высокочистый металл, который восстанавливается на катоде. Таким способом производят цинк, медь и кадмий.
Чтобы предотвратить коррозию и сделать изделие более прочным и декоративным, поверхность одного металла покрывают другим. Этот процесс называется гальваникой.

Гальванопластика — это процесс воспроизведения трехмерных объектов путем электроосаждения металлов.

Применение в вакуумных электронных приборах
Принцип подъема и опускания в вакуумном устройстве можно продемонстрировать на примере электронно-лучевой трубки. Она напоминает герметично закрытый контейнер с металлическими деталями внутри. Устройство используется для выпрямления, генерации и преобразования электрических сигналов. В зависимости от количества электродов они делятся на:
- диоды;
- триоды;
- тетроды;
- пентоды и т.д.
Читайте также.
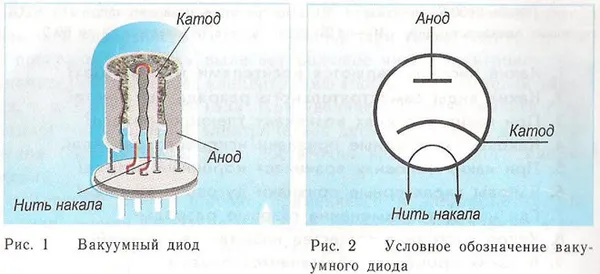
Диод представляет собой вакуумный прибор с двумя электродами — катодом и анодом. Катод подключается к отрицательному полюсу источника питания, а анод — к положительному. Функция катода заключается в испускании электронов при нагревании его электрическим током до определенной температуры. Электроны используются для создания пространственного заряда между катодом и анодом. Более быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер пространственного заряда. Анод подхватывает частицы. Во внешней цепи возникает восходящий ток. Поток электронов контролируется дополнительными электродами, на которые подается электрический потенциал. Диоды используются для преобразования переменного тока в постоянный.
Применение в электронике
Сегодня используются полупроводниковые диоды.
Диоды широко используются в электронике, поскольку они могут проводить ток в прямом, а не в обратном направлении.
Анод и катод: где плюс, а где минус?
Из этого следует, что ток всегда течет в направлении от анода к катоду. Отсюда следует единственный вывод: анод — это плюс, а катод соединен с минусом. С помощью этого правила можно безошибочно определить, где находится плюс, а где минус.
В гальванике реакция восстановления происходит на катоде. Это означает, что положительные ионы из раствора осаждаются на катоде. Мы используем это для определения знака минус.
Выше мы рассмотрели, как определить катод и анод радиоактивного соединения. Если у вас есть схема аппарата, вы можете легко определить направление тока и, следовательно, назначение электродов. Если у вас нет схемы, используйте точки и маркировку на корпусах компонентов.
Примечание: Неправильно использовать термины «катод» и «анод» по отношению к стабилизатору, так как он потребляет ток в разных направлениях.
Я хотел бы обратить ваше внимание на компоненты источника питания. В гальванических устройствах обычно обозначается «+», а на аккумуляторах часто обозначаются оба полюса. На автомобильных аккумуляторах полюс «плюс» толще. По этой маркировке можно также определить полярность клемм.
Клеммы см. на рисунке 6.
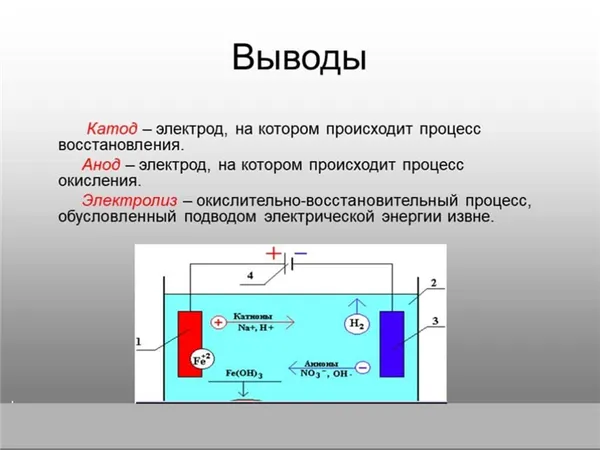
Цифры указаны:
- 1– анод;
- 2 – электролит;
- 3 – катод;
- 4 – источник тока.
Применение
Электроды чаще всего используются в качестве анода и катода:
- в электрохимии;
- вакуумных электронных приборах;
- полупроводниковых элементах.
Давайте в общих чертах рассмотрим области применения анодов и катодов.
В электрохимии
В этой области анод и катод являются ключевыми терминами при проведении электрохимических реакций, используемых в основном для восстановления металлов. Эти реакции называются электролизом. Использование процессов электролиза позволяет получать чистые металлы, поскольку на катоде образуются только положительные ионы металла, содержащегося в растворе электролита.
Процесс электролиза используется для нанесения очень тонкого цинкового покрытия на стальные листы и детали любой конфигурации. Электролитическое покрытие эффективно защищает металл от коррозии.
В вакуумных электронных приборах
Примерами вакуумных устройств являются радиоэлектронные трубки, катодно-лучевые трубки и телевизоры. Они работают по одному и тому же принципу: нагретый катод испускает электроны, которые устремляются к аноду с высоким положительным электрическим потенциалом.
Образование электронов на нагретом электроде называется тепловой эмиссией, а электрический ток, который создается между катодом и анодом, — тепловой эмиссией. Преимущество этих устройств в том, что они проводят ток только в одном направлении — от катода к аноду.
Добавив сетку между электродами, можно регулировать параметры тока в широком диапазоне, изменяя напряжение на сетке. Такие трубки используются в качестве усилителей сигнала. Сегодня вакуумные лампы используются редко, поскольку их успешно заменили миниатюрные полупроводниковые диоды и транзисторы, часто размещенные на одном кристалле в виде микросхемы.
В полупроводниковых приборах
Электронные компоненты на основе полупроводников ценятся за низкое энергопотребление и малые размеры. Они почти полностью заменили вакуумные лампы. Выводы полупроводниковых приборов традиционно называют анодами и катодами.
Несмотря на все преимущества полупроводников, они обладают таким недостатком, как «шумность». В мощных усилителях этот шум заметен. Вакуумные трубки до сих пор используются в усилителях высокого класса.
Электронно-лучевые дисплеи в современных телевизорах заменяются светодиодными дисплеями с подсветкой. Они более экономичны, обеспечивают отличную цветопередачу и практически плоский прием.
Как определить анод и катод
Электрическая схема катода и анода:
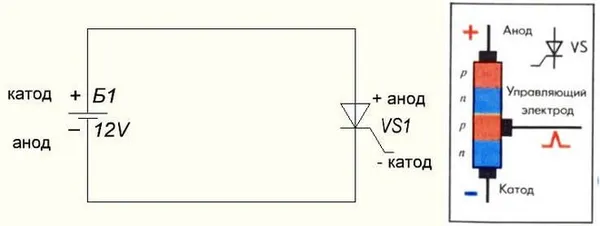
Разница между катодом и анодом основана исключительно на токе, а не на напряжении. Металл, используемый для катода, имеет значительно больше электронов, чем нейтронов или протонов.
Одним из потребителей энергии, например, является постоянный ток. Ток поступает в ячейку через анод из внешней цепи. Электрический ток выходит из ячейки непосредственно через катод во внешнюю цепь. Это немного похоже на перевернутую картинку. Если эти термины сложны, то здесь они понятны только химикам. Теперь необходимо сделать обратное соединение. В этом случае полупроводниковые диоды практически не проводят ток. Однако в элементах существует возможность обратного распада.
Электродные диоды (например, радиолампы) вообще не обладают способностью проводить ток в обратном направлении. Обычно считается, что в них ток отсутствует. Поэтому анодные и катодные выводы диодов обычно не отвечают за эти функции.

В катодной защите металлический анод электрически соединен с защищаемой системой и корродирует или частично растворяет металл защищаемой системы. Этот металлический анод лучше реагирует на коррозионную среду защищаемой системы. Корпус корабля из железа или стали может быть защищен цинковым анодом, который растворяется в морской воде и предотвращает коррозию корпуса.
Менее очевидным примером такого типа защиты является гальванизация железа. В этом процессе железные конструкции (например, заборы) покрываются слоем металлического цинка. Пока цинк остается неповрежденным, железо защищено от коррозии. Со временем








