Временная жесткость воды напрямую связана с наличием в ней гидрокарбонатов, которые обладают высоким уровнем растворимости в воде. При нагреве, например, во время кипячения, эти гидрокарбонаты разлагаются на углекислый газ и карбонаты, и именно карбонаты затем оседают в виде накипи на стенках кухонных кастрюль или чайников.
Жесткая и мягкая вода — что это значит. Виды жесткости воды
Нередко клиенты обращаются к нам за разъяснениями по поводу жесткой и мягкой воды, интересуясь их особенностями и возможностями смягчения. Мы подготовили несколько статей на данную тему. Надеемся, что в них вы найдете ответы на большинство ваших вопросов о жесткой и мягкой воде.
Если говорить простыми словами, жесткая вода — это H2O, в которой содержится значительное количество растворенных солей щелочноземельных металлов, прежде всего кальция и магния (в виде катионов Са и Mg), тогда как мягкая вода содержит их в минимальных количествах. Уровень содержания так называемых солей жесткости в воде измеряется в миллиграмм-эквивалентах на литр — мг-экв./л. Например, один мг-экв./л означает, что в литре данной воды присутствует 20,04 мг катионов Са или 12,16 мг катионов Mg (это определяется делением атомной массы на валентность).
Существует несколько классификаций жесткости воды. В России вода считается жесткой, если в ней содержится более 10 мг-экв./л солей. Вода, в которой обнаруживаются от 2 до 10 мг-экв./л солей, классифицируется как средне жесткая, а если уровень солей составляет менее 2 мг-экв./л — это считается мягкой водой.
Интересный факт: дождевая вода в своем естественном состоянии является мягкой, так как прежде чем упасть на землю, она проходила стадию испарения. Во время испарения соли жесткости не переносятся вместе с ней, что приводит к естественной фильтрации. Жесткость воды появляется, когда она проходит через почву, собирая различные соли.
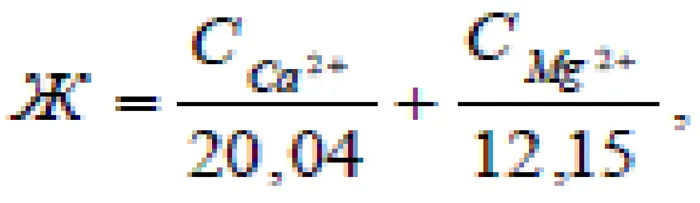 |
 |
| Государственный стандартный образец (ГСО) Общая жесткость воды |
Набор для измерения жесткости воды |
Откуда взялись названия жесткая и мягкая
С древних времен люди замечали, что вещи, постиранные в одной воде, становятся мягкими, а в другой — грубыми или жесткими. В связи с этим было вполне логично назвать воду, которая способствует смягчению тканей, мягкой, а ту, что делает их жесткими, — жесткой.
Кстати, иногда люди ассоциируют мягкую воду с жизненной энергией, называя её живой, а жесткую — мертвой. Однако это является ошибочным мнением. Существуют термины «живая» и «мертвая» вода, но они не имеют отношения к мифам о целебных свойствах живой воды и губительных качествах мертвой. Эти термины скорее указывают на некоторые неофициальные теории, которые воспринимаются без научного признания. Вода с щелочной реакцией может обладать некоторыми удобными свойствами, а кислые воды принято считать мертвыми. Тем не менее это мало связано с категорией жесткости или мягкости воды.
Понятие щелочности воды
Щелочность воды определяется как сумма гидроксильных ионов и анионов слабых кислот, таких как угольная или органическая кислота, а также бикарбонатные и карбонатные ионы. Таким образом, щелочность воды является аспектом жесткости с точки зрения анионов.
Выделяют три основных типа щелочности: бикарбонатную, карбонатную и гидратную.
Щелочность природных или очищенных вод характеризует их способность связывать эквивалентное количество сильных кислот. Основной причиной щелочности является присутствие анионов слабых кислот (к примеру, карбонаты, гидрокарбонаты). Общая щелочность определяется как сумма всех этих анионов. Чаще всего общая щелочность воды ассоциируется исключительно с анионами угольной кислоты — это и называется карбонатная щелочность. В процессе гидролиза аниионы образуют гидроксид-ионы:
CO3 2- + H2O HCO3 — + OH
HCO3 — + H2O H2CO3 + OH
Следует отметить, что щелочность определяется объемом сильной кислоты, необходимой для нейтрализации одного дециметра кубического (1 дм3) воды. Щелочность большинства природных вод, как правило, формируется за счет гидрокарбонатов кальция и магния, при этом pH этих вод обычно не превышает значения 8,3.
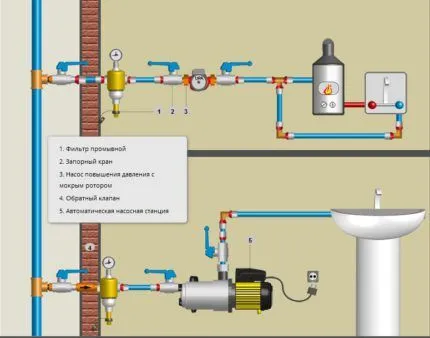
Устранение жесткости ионообменным методом
Существует множество методов устранения жесткости воды (например, термический, реагентный, диализ и ионный обмен). Выбор метода смягчения воды в значительной степени зависит от исходного качества воды, глубины необходимого смягчения и технико-экономических факторов. В нашей компании основной метод — это именно ионный обмен (катионитовый), который мы подробно рассмотрим.
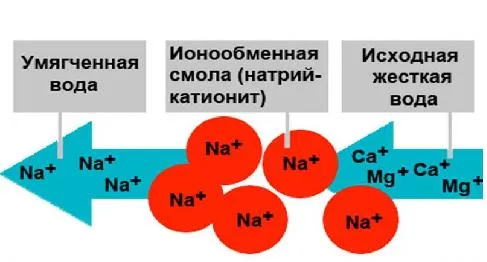
Суть метода ионного обмена заключается в замене ионов Са2+ и Mg2+ на ионы Na+ или Н+ в процессе пропускания воды через ионные смолы, которые функционируют в роли фильтрующей загрузки. Процесс смягчения воды с использованием Н-катионита может быть выражен следующими реакциями:
При этом важно отметить, что если используется Н-катионит, то устранение жесткости сопровождается образованием сильной соляной кислоты, что может привести к коррозии металлических конструкций и труб. Чтобы избежать этих проблем, рекомендуется применять Na-катионит:
2R — Na + MgCl2 = R2 — Mg + 2NaCl
2R — Na + CaSO4 = R2 — Ca + Na2SO4
2R — Na + CaCO3 = R2 — Ca + Na2CO3
2R — Na + Ca(HCO3)2 = R2 — Ca + 2NaHCO3

Приведенные выше уравнения демонстрируют, что при натрий-катионировании карбонатная жесткость воды перерабатывается в натриевую щелочность. Иными словами, щелочность воды не изменяется, что является одним из основных недостатков данной процедуры. Анионный состав воды также остается прежним, так как анионы SO42-, Cl— и другие полностью переходят в умягченную воду. Происходит лишь более или менее полная замена катионов кальция и магния на катионы натрия, что приводит к снижению жесткости натрий-катионированной воды при одновременном увеличении ее общего состава.
Мягкие воды удовлетворяют большинству требований, предъявляемых различными отраслями промышленности, когда речь идет о воде для охлаждения, производства пара и других процессов. Мягкие воды требуют минимальной обработки при производстве синтетических волокон, пластиков, мыльных растворов и в других случаях. К тому же в мягких водах наблюдается угнетение активности бактерий, что позволяет снижать дозировки биоцидов в системе оборотного водоснабжения.
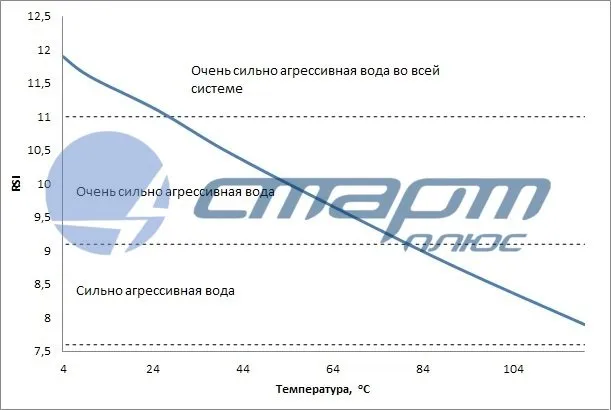
Однако наряду с положительными качествами у мягкой воды есть и серьезные недостатки, одним из которых является повышенная коррозионная активность к основным материалам водопроводных систем. Это происходит из-за недостатка ионов жесткости в воде. Для оценки коррозионной активности разработаны различные индексы, среди которых индекс Ланжелье и индекс стабильности Ризнера.
Катионообменная смола
Индекс Ланжелье и индекс стабильности Ризнера
Исследование, проведенное американским ученым Ланжелье в 1936 году, дало возможность оценивать стабильность раствора, применяя формулу, основанную на степени насыщения раствора карбонатом кальция. Нестабильность этого раствора может привести к коррозии или образованию накипи.
Формула для индекса Ланжелье выглядит следующим образом: pH — pHs .
Для определения этого индекса необходимы следующие параметры:
Зачем определять временную и постоянную жесткость
Знание долей карбонатной и некарбонатной жесткости в общем показателе позволяет определить:
- как именно можно использовать воду – допустима ли она для питья или предназначена исключительно для технических нужд;
- какие системы очистки будут необходимыми в каждом конкретном случае.
Сложная система водоочистки может сделать использование воды из ближайшего источника нецелесообразным. В зависимости от задач предприятия может оказаться более выгодным организовать доставку питьевой воды или же сэкономить на очистке, но закладывать в бюджет более частый ремонт оборудования.
Снизить временную жесткость можно следующими способами:
- нагреванием (что имеет смысл, если доступен недорогой источник тепла);
- с помощью химических реагентов — их добавляют для образования малорастворимых солей кальция и магния (выбор конкретного реагента зависит от соотношения KH и GH);
- термохимическим методом — применение нагрева в сочетании с реагентами.
Чтобы полностью убрать все соли, применяются такие методы, как диализ (или нанофильтрация), ионообмен, дистилляция и вымораживание для небольших объемов воды. Наилучших результатов достигают в результате комбинации нескольких методов.
Как в лаборатории измеряют показатели жесткости воды
Существует несколько ключевых методов для определения жесткости воды.
Комплексонометрический метод используется для оценки общей жесткости и требует предварительной подгонки образца до приемлемых уровней мутности и цветности, удаления некоторых компонентов, и последующей титрации с использованием индикатора. Подготовка пробы зачастую оказывается трудоемкой, и любая ошибка в ходе процесса может привести к раскрыванию погрешностей в измерениях.
Метод масс-спектрометрии, который применяется в аккредитованной лаборатории Веста, является более эффективным. Он менее чувствителен к примесям в образце, так как анализ практически полностью автоматизирован. Точность измерений гарантируется регулярными проверками и участием в межлабораторных сличительных экспериментах.
В ходе исследования можно точно установить не только уровень общей жесткости, но и вклад карбонатов и других солей в этот показатель. Это дает полное представление о качестве воды в источнике, позволяя более обоснованно подойти к вопросу водоподготовки и достичь более предсказуемых результатов.
В питьевой воде согласно нормам СанПиН 2.1.3684-21 не допускается превышение предельно допустимых концентраций таких элементов, как алюминий, барий, кадмий, марганец, бериллий, железо, молибден, мышьяк, ртуть, никель, стронций, хром, свинец, селен, цинк и бора, который считается металлоидом.
Эффективная очистка сточных вод является необходимостью для большинства производств. При использовании химических методов в сточные воды добавляются реагенты, что приводит к образованию новых веществ, иногда в результате реакций остаются непрореагировавшие остатки, которые могут оказать негативное влияние на экологию.
Общая радиационная обстановка обычно не воспринимается человеком.
- Экспертиза сроков годности.
- Экспертиза проектов санитарно-защитных зон (СЗЗ), предельно допустимых выбросов (ПДВ), оценки воздействия на окружающую среду (ОВОС).
- Экспертиза проектов перепланировки.
В чем измеряется жесткость воды?
Показатель жесткости воды измеряется в соотношении ионов кальция и магния, присутствующих в ней в определенных количествах. Согласно международной системе единиц, жесткость измеряется в молях на кубический метр. На практике же в нашей стране используется несколько единиц измерения: градусы жесткости (ºЖ) и миллиграмм-эквиваленты на литр (мг-экв/л). Один мг-экв/л олицетворяет содержимое 20,04 мг кальция и 12,16 мг магния в одном литре воды. Также можно отметить, что 1ºЖ эквивалентно 1 мг-экв/л.
В зависимости от содержания солей вода делится на:
- очень мягкую – до 1,5 мг-экв/л;
- мягкую – 1,5-4 мг-экв/л;
- средней жесткости – 4-8 мг-экв/л;
- жесткую – 8-12 мг-экв/л;
- очень жесткую – более 12 мг-экв/л.
Оптимальный уровень жесткости воды, необходимой для различных целей, должен составлять от 1 до 2 мг-экв/л. Уровень жесткости водопроводной воды может колебаться в пределах 1,5-5 мг-экв/л, что обычно не требует применения специальных мер по корректировке этого показателя. Жесткая вода чаще бывает в индивидуальных скважинах и требует более тщательной очистки и смягчения. Согласно санитарным нормам, жесткость питьевой воды из централизованных источников водоснабжения не должна превышать 7 мг-экв/л.
Как быстро и качественно определить уровень жесткости воды?

Чтобы убедиться в качестве воды, которая поступает из вашего крана, рекомендуем отправить образец на анализ в специализированную лабораторию. В АНО Испытательный центр НОРТЕСТ вы можете заказать анализ воды из любого источника. Наши специалисты проведут всестороннюю проверку, чтобы определить качественные и количественные показатели, включая концентрацию солей жесткости, уровень железа, нитратов и других вредных веществ, которые могут присутствовать в питьевой воде. Особенно стоит провести анализ воды на жесткость в тех случаях, когда необходимо подобрать систему фильтрации для загородного дома.
Методы устранения жёсткости водопроводной или скважинной воды
Существуют множество способов уменьшить жесткость воды. Концентрацию солей магния и кальция можно снижать различными методами. Выбор конкретного метода зависит от типа жесткости, уровня содержания и объемов соединений Mg и Ca, а также от наличия других химических элементов.
В таблице ниже кратко описаны методы снижения жесткости воды в зависимости от ее типа:
| Вид жесткости | Методы снижения концентрации солей магния и кальция |
| Временная, она же карбонатная | Термические (физические) способы, например, кипячение. |
| Постоянная, она же некарбонатная | Химические методы, например, добавление кальцинированной соды. |
| Общая | Можно использовать как термические, так и химические способы: нагревание, кипячение, замораживание с последующим оттаиванием, добавление гашеной извести или кальцинированной соды, а также ионообменные и обратнопроницаемые системы, фильтры-умягчители. |
Далее мы подробно рассмотрим все технологии, применяемые для устранения повышенной жесткости воды.
Кипячение
При рассмотрении жесткости воды и методов её устранения обычное кипячение можно отнести к простым бытовым методам. Это процесс, известный как термоумягчение, который предполагает либо достижение состояния кипения, либо нагревание до температур свыше 70 градусов по Цельсию.
Кипячение эффективно решает проблему временной жесткости. При нагревании начинается реакция, в которой гидрокарбонаты разлагаются. Этот процесс также сопровождается образованием побочного вещества — угольной кислоты. Основные карбонаты, включая карбонат кальция, выпадают в виде осадка, формируя накипь и хлопья, которые оседают на поверхности.
Главное достоинство этого метода заключается в его простоте: он является эффективным и легко применим в быту. Однако термические способы устранения временной жесткости малозначимы при работе с постоянной, некарбонатной жесткостью. Они не в состоянии удалить другие соли щелочноземельных металлов. Также следует отметить низкую производительность данного метода и его высокую энергозатратность, что затрудняет одновременное умягчение больших объемов жидкости. Кроме того, наличие надежного источника тепла является необходимым условием для термической обработки.
Реагентное, химическое умягчение
Понятие реагентного, или химического, умягчения подразумевает использование химических соединений, которые запускают реакции, способствующие оптимизации жесткости воды. Соли жесткости удаляются посредством превращения из растворимой формы в нерастворимую с последующим удалением образовавшегося осадка.
В качестве реагентов для химического умягчения воды применяются:
- Полифосфаты натрия, такие как ортофосфат, который часто входит в состав средств для умягчения как в быту, так и в промышленности.
- Кальцинированная сода преобразует соли кальция в нерастворимые карбонаты, которые затем убираются с помощью фильтрации на следующем этапе очистки.
- Гидроксид кальция, то есть гашеная известь, позволяет устранить карбонатную временную жесткость воды.
- Комбинация гашеной извести и кальцинированной соды, если необходима корректировка общей или постоянной жесткости воды. Такой способ подразумевает, что известь воздействует на гидрокарбонаты и карбонаты, а сода — на прочие соли.
Что выбрать
Если вашей целью является качественное и эффективное умягчение жесткой воды, то необходимо продуманное распределение систем очистки. В процессе выбора учитывайте основные факторы, которые были представлены ранее. Разнообразные рекомендации, содержащиеся в данной статье, могут помочь вам найти наилучшее решение и добиться наиболее качественного умягчения воды.